Considerações práticas#
Recomendamos conferir Microtutor e MyScope para explicações interativas de muitos desses conceitos!
Escolha da objetiva#
As objetivas do microscópio têm vários recursos que devem ser considerados ao decidir qual objetiva é a certa para o seu experimento
Ampliação e resolução: quanto maior a abertura numérica (NA) da lente, maior a resolução que se pode obter em sua amostra. O NA é calculado como \(NA=RI * sin(θ)\), relacionado tanto ao índice de refração da amostra, vidro e o meio de imersão, bem como ao intervalo de ângulos de luz emitida que pode ser coletada na lente. A menos que técnicas especiais sejam usadas, o limite típico é calculado como \(d = λ / 2NA\), o que significa que a resolução é definida pelo NA da lente, mas também pelo comprimento de onda da luz utilizada para a geração de imagens.
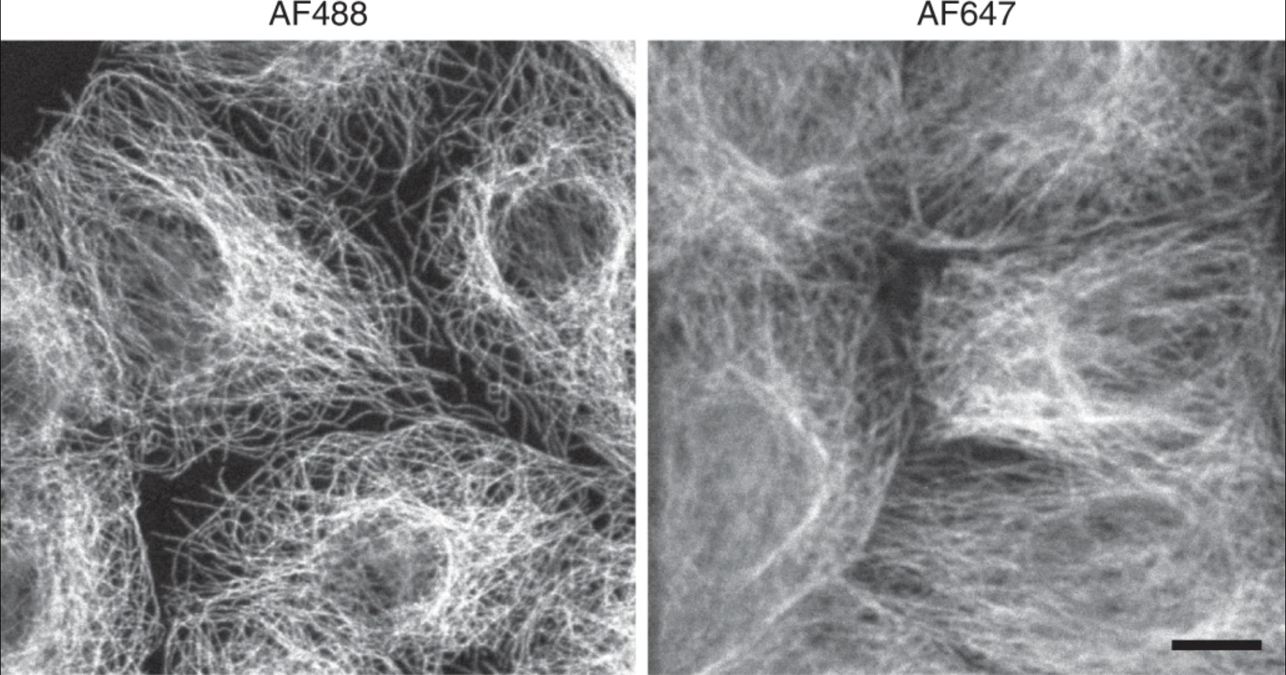
Fig. 5 Resolução reduzida em comprimentos de onda de luz mais longos. Os microtúbulos fotografados em um comprimento de onda de luz mais curto mostram uma resolução maior do que aqueles fotografados em comprimentos de onda mais longos. Adaptado de Jonkman J., Brown C.M., Wright G.D et al. Tutorial: orientação para microscopia confocal quantitativa. Nat Prot 15, (2020) 5#
Correção de cores: Ao realizar a microscopia multicolorida, é importante escolher uma lente objetiva rotulada como “Apo” ou “Super Apo”, pois essas lentes são corrigidas para focar de 3 a 6 cores no mesmo plano ao mesmo tempo. As lentes
Fluornormalmente focam duas cores ao mesmo tempo.Distância de trabalho: A distância de trabalho (WD) dá a distância em milímetros que a lente pode focalizar na amostra. Essa distância inclui a lamínula e o meio de montagem. Ao obter imagens de uma amostra espessa e/ou se precisar obter imagens longe da superfície da amostra, é importante garantir que a lente tenha uma distância de trabalho suficiente.
Conjuntos de filtros#
É importante certificar-se de que o microscópio no qual você deseja obter imagens possui os conjuntos de filtros corretos para os fluoróforos que deseja usar. Veja a seção sobre bleedthrough para mais informações.
amostragem em Z#
Se você deseja capturar várias seções z, o espaçamento dessas seções é importante se desejar realizar uma reconstrução 3D precisa. O site da SVI tem uma explicação matemática mais completa sobre isso, bem como uma [calculadora online] fácil de usar (https://svi.nl/NyquistCalculator) que você pode usar para calcular o espaçamento ideal da seção z para suas condições de imagem.
Potência/velocidade de aquisição#
A quantidade de sinal capturado de qualquer fluoróforo estará relacionada não apenas ao brilho intrínseco do fluoróforo, mas também à quantidade de luz de excitação à qual ele é exposto (devido à duração, potência ou ambos), bem como à quantidade de tempo e a multiplicação do sinal que acontece no detector (normalmente uma câmera ou um tubo fotomultiplicador (PMT)). Um experimento ideal é tipicamente aquele que minimiza a quantidade de luz que atinge a amostra (para reduzir o fotobranqueamento e/ou fototoxicidade) enquanto obtém sinal fluorescente adequado e em tempo mínimo no equipamento. Como equilibrar esses fatores concorrentes dependerá da biologia exata que está sendo estudada e das restrições do pesquisador.
